

کیمیا تهران اسید مرجع تخصصی خرید، فروش و قیمت
میباشد. خرید مطمئن و قیمت به روز را از ما بخواهید!
اسید سولفوریک یک اسید معدنی خورنده با ظاهری شیشه ای و روغنی است که نام قبلی آن روغن ویتریول بوده و نام های دیگر آن اسید سولفین، سولفات هیدروژن است.
فرمول اسید سولفوریک، H2SO4، نشان دهنده وجود یک اتم گوگرد است که توسط دو ترکیب هیدروکسید و دو اتم اکسیژن احاطه شده است. خرید اسید سولفوریک قدرتمند در صنایع مختلف، در درجه اول برای تولید کود و مواد شیمیایی رایج است. در واقع فروش اسید سولفوریک در غلظت های مختلف برای استفاده در ساخت رنگدانه ها، رنگ ها، داروها، مواد منفجره، مواد شوینده و نمک ها و اسیدهای غیر آلی و همچنین فرآیندهای تصفیه نفت و متالورژی انجام می شود. پیشنهاد می شود برای اطلاع از قیمت اسید سولفوریک 50 درصد و یا تصمیم آگاهانه برای خرید اسید سولفوریک 35 درصد با ما همراه باشید.
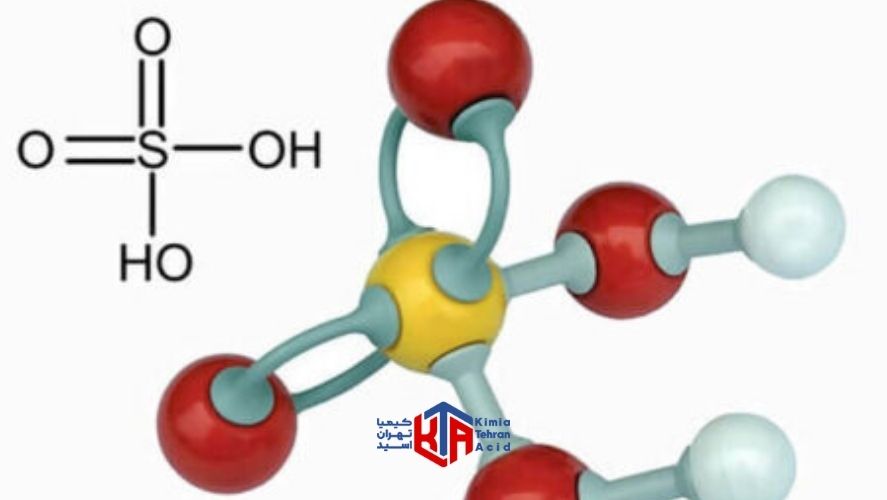
1.اسید سولفوریک غلیظ گرم باعث اکسید مس به سولفات مس می شود.
Cu + 2H2SO4 → CuSO4 + SO2 + H2O
2.اسید سولفوریک غلیظ از کلرید سدیم کلرید هیدروژن می دهد. همچنین ، هیدروژن فلوراید از کلسیم فلوراید می دهد.
CaF2 + H2SO4 → CaSO4 + 2HF
3.گلوکز ، قند و نشاسته را در کربن می سوزاند.
C12H22O11 + (H2SO4) → 12C + 11H2O

1. روش اول :
اولین روش تجاری موفق برای ساخت اسید سولفوریک در سال 1746 توسط پزشک ، شیمی دان و مخترع انگلیسی جان روبوک (1794-1718) ساخته شد.
روش Roebuck را فرآیند محفظه سرب می نامند زیرا این اسید در ظروف بزرگ پوشانده شده با سرب ساخته می شود.
فرآیند اتاق سرب شامل سه مرحله اصلی است :
اگرچه این فرآیند کاملاً ساده به نظر می رسد ، اما واکنش ها در واقع به دلیل ترکیبات دیگری که برای ایجاد واکنش لازم است ، تا حدودی پیچیده است.

2. روش دوم :
روش دیگر برای ساخت اسید سولفوریک به عنوان فرایند تماس شناخته می شود.
در حدود سال 1830 توسط یک تاجر سرکه انگلیسی از بریستول ، پرگرین فیلیپس اختراع شد.
واکنشهای شیمیایی دخیل در فرآیند فیلیپس با واکنشهای موجود در محفظه سرب یکسان است ، اما آنها از طریق کاتالیزوری از فلز پلاتین ریز تقسیم شده انجام می شوند.
فیلیپس دریافت که عملکرد به دست آمده بسیار بیشتر از فرآیند محفظه سرب است.
کشف اسید سولفوریک به جابر بن حیان ، کیمیاگر قرن هشتم نسبت داده می شود.
بعداً پزشک و کیمیاگر قرن نهم زکریای رازی ، این ماده را با تقطیر خشک مواد معدنی از جمله هپتاهیدرات سولفات آهن و سولفات مس (II) پنتاهیدرات ، بدست آورد و مورد مطالعه قرار داد.
در ادامه با گرم شدن ، این ترکیبات به ترتیب به اکسید آهن (II) و اکسید مس (II) تجزیه می شوند و باعث ترشح آب و تری اکسید گوگرد می شوند که با ترکیب آنها محلول رقیق اسید سولفوریک تولید می شود.
اسید سولفوریک غیر آلی است زیرا حاوی اتمهای کربن متصل به اتمهای اکسیژن، نیتروژن و هیدروژن نیست.
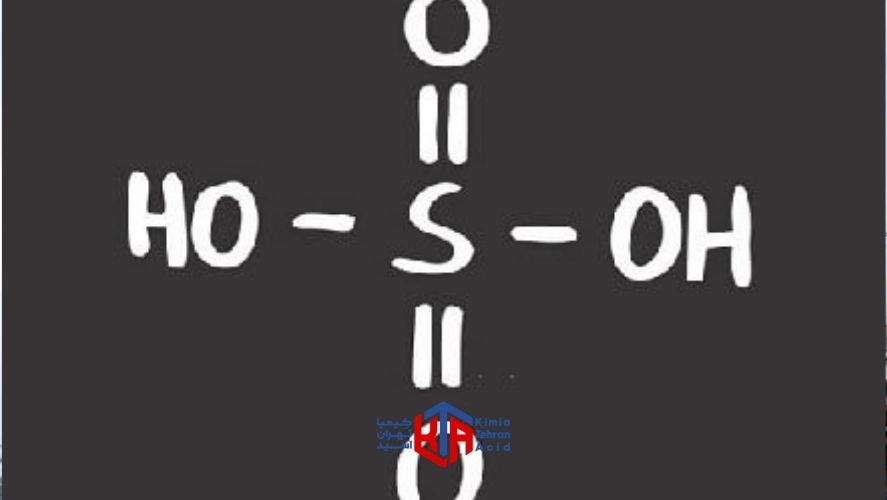
خرید اسید سولفوریک از طریق سایت های مرجع فروش اسید سولفوریک همانند شرکت کیمیا تهران اسید که نازل ترین قیمت اسید سولفوریک را برا ی شما در نظر گرفته اند، رایج است.
برای هر کسی قانونی است که شناسنامه ماده شیمیایی را مطالعه کند و پس از مشاوره با کارشناسان و بسته به هدف کاربرد ماده و غلظت مورد نیاز، تصمیم به خرید اسیدسولفوریک 50 درصد یا خرید اسید سولفوریک 35 درصد یا غلظت 98 درصد آن بگیرد.
بازارهای جهانی اسید سولفوریک هر هفته تحت پوشش خبرگزاری های خدمات اطلاعاتی مستقل کالا قرار می گیرد.
این خبرگذاری ها دیدگاه جهانی در مورد بازار کود به شما می دهد و برای تجارت بین المللی کود طراحی شده است.
این تفسیرها شامل روند عرضه و تقاضا ، اخبار تولید ، سوالات حمل و نقل ، قیمت کود و محرک ها و نوسانات قیمت اسید سولفوریک است.
اسید سولفوریک صنعتی معمولا در گالن های 5 لیتری، 20 لیتری، بشکه های 220 لیتری و تانکرهای 1000 لیتری موجود می باشد.
اطلاعات اسید سولفوریک که در این صفحه مطالعه کردید از وبسایت مرجع science direct برداشته شده و کاملا قابل اطمینان است.
استفاده و خرید اسید سولفوریک در بخش صنایع معمول است.
این اسید چند وجهی به مقدار زیاد تولید می شود و سومین ماده شیمیایی صنعتی است که به طور گسترده تولید می شود.
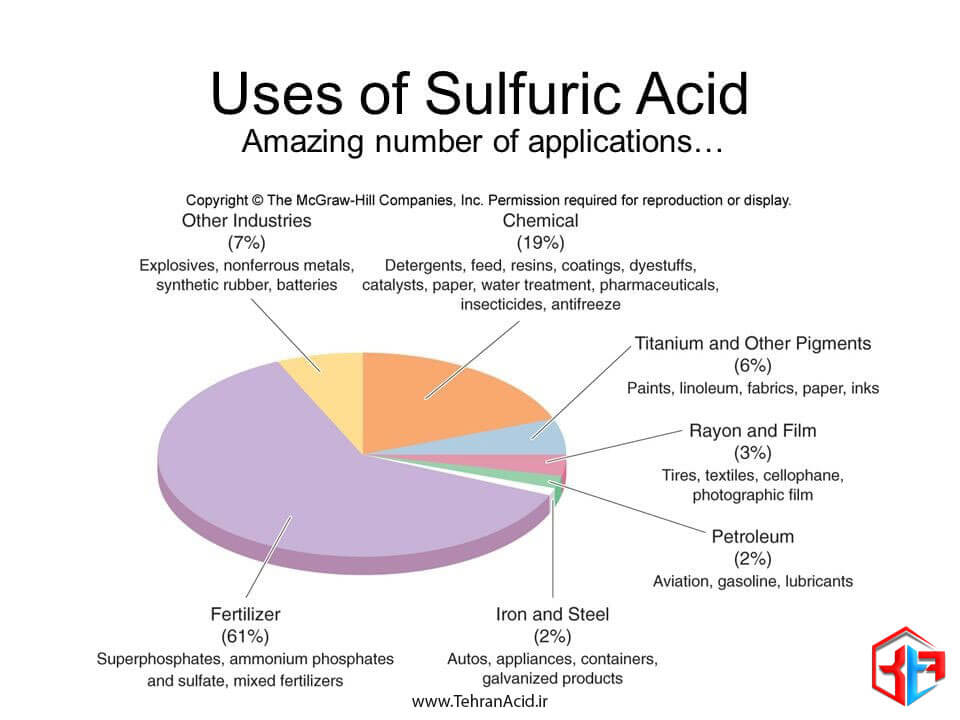
در تولید کود از اسید سولفوریک برای افزودن گوگرد به خاک استفاده می شود. بیشتر زمین های کشاورزی به منبع گوگرد احتیاج دارند تا جای آنچه را که در دوره های بارانی توسط گیاهان زراعی استفاده می شده یا شسته شده است ، جایگزین کند.به همین منظور خرید اسید سولفوریک در بین کشاورزان رایج است.
کمبود گوگرد منجر به زردی برگ ، نکروز برگ و بافت و توقف رشد می شود. در حالی که گیاهان نمی توانند از گوگرد ابتدایی استفاده کنند ، باکتری های خاک با اکسید آن سولفات تشکیل می دهند. سولفات مهمترین منبع تغذیه برای تمام زندگی گیاهان است و گیاهان می توانند به راحتی آن را از طریق ریشه جذب کنند.
اسید سولفوریک تولید شده برای صنایع کود ناخالص است و دارای کمی رنگ با غلظت بین 78 تا 93 درصد است.
شما می توانید برای تصمیم آگاهانه تر برای خرید اسیدسولفوریک 50 درصد یا 35 درصد با کارشناسان ما در تماس باشید.

خرید اسید سولفوریک برای استفاده در تولید مواد شیمیایی شامل تولید کاپرولاکتام برای الیاف نایلون و دی اکسید تیتانیوم است که یک رنگدانه سفید روشن است. علاوه بر این ، اسید سولفوریک برای تولید اسید هیدروفلوئوریکی که جایگزین کلروفلوئوروکربن ها (CFC) شده است برای استفاده در یخچال ها یا سیستم های تهویه هوا ضروری است.
نمک های سولفات مانند سولفات کلسیم (گچ) و سولفات هیدروژن مشتقات این اسید خاص هستند.
اگرچه سولفیتهای فلزی به طور کلی در آب حل نمی شوند ، اما نمکهای سولفات دیگر کاملاً برعکس هستند و اسید سولفوریک را به یکی از آسان ترین و بهترین حلالها برای استفاده در طیف وسیعی از صنایع تبدیل می کنند.
فروش اسید سولفوریک با هدف استفاده در ساخت مواد منفجره نیز انجام می شود. افزودن اسید نیتریک و اسید سولفوریک به سلول باعث ایجاد نیتروسلولز بسیار قابل اشتعال می شود.
به همین دلیل ، خرید اسید سولفوریک در مقادیر زیاد نیاز به مجوز دارد. اسید سولفوریک با درجه تجاری با حداقل غلظت 95٪ به فروش می رسد.
اما خرید اسید سولفوریک 50 درصد تجاری نیز برای کاربرد های دیگر مرسوم است.
در آزمایشگاه ، خرید اسید سولفوریک به عنوان ماده خشک کننده توسط متخصصین رایج است و در تجزیه و تحلیل کمی که غلظت محلول با استفاده از روشی معروف به تیتراسیون محاسبه می شود ، استفاده می شود.
هر زمان که آب به اسید اضافه شد (از واکنش با اسید سولفوریک مراقب باشید و همیشه اسید را به آب اضافه کنید ، نه برعکس) ، یون های هیدروژن با بار مثبت از طریق اهدا پروتون از اسید آزاد می شوند.
بازها یا مواد قلیایی مانند هیدروکسید سدیم به دلیل پذیرش پروتون ، در حضور آب یون های هیدروکسید با بار منفی تولید می کنند.
یک نمونه از کاربردهای تیتراسیون ممکن است تعیین غلظت محلول اسید سولفوریک باشد.
اسید سولفوریک یک الکترولیت است. الکترولیت یک محلول است که در آن یونها وجود دارند. باتری های اسید سرب در اتومبیل ها از مجموعه صفحات اکسید سرب با بار مثبت غوطه ور شده در الکترولیت و صفحات سرب خالص با بار منفی تشکیل شده اند ، به همین ترتیب غوطه ور شده اند. این الکترولیت اسید سولفوریک رقیق شده (تقریباً 33٪) است. به همین دلیل است که اسید سولفوریک اغلب به عنوان اسید باتری شناخته می شود و خرید اسید سولفوریک توسط متخصصین این حرفه رایج است.

باتری های اتومبیل انرژی شیمیایی را ذخیره کرده و از طریق واکنش های هیدروژن ، اکسیژن ، سرب و گوگرد با یکدیگر این انرژی را به انرژی الکتریکی تبدیل می کنند. وجود آب مقطر (خالص) در اسید سولفوریک باعث تولید هیدروژن و سولفات می شود.
وجود اکسیژن و هیدروژن اضافی در محلول باعث تولید آب و کاهش غلظت اسید سولفوریک می شود. وقتی این غلظت خیلی کم است ، باتری باید تعویض یا شارژ شود.
از اسید سولفوریک غالباً در صنایع غذایی برای آبگیری برخی مواد خوراکی مانند میوه یا جلوگیری از رشد باکتری ها و سایر میکروب های مضر که روند پوسیدگی را تسریع می کنند ، استفاده می شود.
به صورت اسپری برای نگهداری گوشت یا مرغ استفاده می شود. اسید سولفوریک همچنین یک افزودنی غذایی برای اهداف عمومی است که در نوشیدنی های الکلی و پنیر استفاده می شود.
برای خشک کردن میوه ها ، توانایی اسید سولفوریک در حذف آب بسیار مورد توجه است.
در فرآیندهای خشک کردن میوه ، خرید اسید سولفوریک غلیظ برای در تماس مستقیم قرار دادن با میوه نیست بلکه در عوض برای خشک کردن هوای اطراف آن ، از بین بردن رطوبت و کمک به تسریع روند کمبود آب استفاده می شود.
اسید سولفوریک سازنده باران اسیدی است و در اثر اکسیداسیون اتمسفر گاز دی اکسید گوگرد در حضور رطوبت ایجاد می شود. از آنجا که دی اکسید گوگرد در هنگام سوزاندن سوخت های فسیلی یا توسط کارخانه های تولید ، برای تولید برق و گرمایش یا توسط وسایل نقلیه تولید می شود ، باران اسیدی در درجه اول یک پدیده ساخته شده توسط بشر است. رسوب خشک به صورت ذرات اسیدی به این معنی است که اسیدها می توانند ته نشین شده و بعداً توسط باران شسته شوند ، آب اسیدی را به اکوسیستم های آب شیرین و دریایی و همچنین محیط های زمینی برسانند.
این می تواند به زندگی گیاهان و حیوانات آسیب برساند.
یک مخلوط معمول حاوی 3 قسمت اسید سولفوریک غلیظ و 1 قسمت محلول 30٪ پراکسید هیدروژن است. در سایر پروتکل ها ممکن است از یک مخلوط 4: 1 یا حتی 7: 1 استفاده شود.
باید هنگام خرید اسید سولفوریک دقت کرد تا به شرایط استفاده از آن مطالعه شود و در هنگام فروش اسید سولفوریک به مشتری تمام نکات تکمیلی گفته می شود:
خواص خورنده اسید سولفوریک با واکنش بسیار گرمازا با آب برجسته می شود.
از این رو سوختگی حاصل از اسید سولفوریک به طور بالقوه جدی تر از اسیدهای قوی قابل مقایسه است (به عنوان مثال اسید کلریدریک) ، زیرا آسیب بافتی اضافی به دلیل کم آبی و به ویژه به دلیل گرمای آزاد شده توسط واکنش با آب ، یعنی آسیب ثانویه حرارتی وجود دارد.
پس احتیاط لازم را هنگام خرید و فروش اسید سولفوریک بخرج دهید.
اگرچه اسید سولفوریک غیر قابل اشتعال است، اما تماس با فلزات در صورت نشت می تواند منجر به آزاد شدن گاز هیدروژن شود. پراکندگی آئروسل های اسیدی و دی اکسید گوگرد گازی یک خطر اضافی در آتش سوزی های اسید سولفوریک است.
نکته اینکه به دلیل خطر پراکندگی بیشتر آئروسل ها ، نباید از آب به عنوان ماده خاموش کننده استفاده کرد.
اسید سولفوریک علاوه بر خطر خورنده آشکار ، سمی در نظر گرفته نمی شود و خطرات اصلی شغلی تماس پوستی منجر به سوختگی است و استنشاق آئروسل ها.
توانایی اسید سولفوریک در ایجاد سرطان در حیوانات آزمایشگاهی مطالعه نشده است. آژانس بین المللی تحقیقات سرطان (IARC) تعیین کرده است که قرار گرفتن در معرض شلیک اسید معدنی قوی حاوی اسید سولفوریک برای انسان سرطان زاست.


اسید سولفوریک باید به عنوان زباله خطرناک در ظرف مناسب مواد زائد اسیدی دفع شود ، و همیشه بسته نگه داشته شود.

800 ppm غلظت کشنده 50٪ انسان برای 5 دقیقه قرار گرفتن در معرض (LC50) است. غلظت بیش از 1000 ppm حتی پس از استنشاق یک تنفس باعث از بین رفتن فوری با از دست دادن تنفس می شود.
پس استفاده از لوازم ایمنی در تمام فرآیند تولید تا فروش اسید سولفوریک الزامی است .
پاک کننده های تخلیه اسیدی معمولاً حاوی اسید سولفوریک با غلظت بالا هستند. این ماده می تواند سلولز ، پروتئین هایی مانند مو و چربی ها را از طریق هیدرولیز اسید حل کند.
اسید سولفوریک یک اسید اکسید کننده است و می تواند فلزات نجیب مانند مس را نیز حل کند. به عنوان یک اسید دی بازیک قوی ، H2SO4 با تشکیل هیدروژن و سولفاتهای هیدروژن و سولفاتهای هیدروژن ، کلیه فلزات پایه را حل می کند.
اسید سولفوریک یک مایع روغنی بی رنگ است. با آزاد شدن گرما در آب محلول است. برای فلزات و بافت خورنده است. در اثر تماس ، چوب و بیشتر مواد آلی ذغال سنگ خرد می شود ، اما بعید است باعث آتش سوزی شود.
اگر مایل به تهیه اسید سولفوریک هستید باید بگوییم که جای خوبی آمده اید ! زیرا شرکت کیمیا تهران اسید از بزرگترین مراکز فروش مواد شیمیایی می باشد و با سالها تجربه مشغول به کار است. شرکت ما به دلیل حذف واسطه ها قیمت اجناس و کالا ها را بسیار پایین اورده است و شما می توانید هر مواد شیمیایی که به آن نیاز داشتید مخصوصا همین اسید سولفوریک ارزان تر از همه جا تهیه کنید.
اسید سولفوریک 98 درصد یک اسید معدنی خورنده با ظاهر شیشه ای و روغنی است. نام قبلی این اسید روغن ویتریول بوده است.
نام های دیگر آن اسید سولفین، سولفات هیدروژن است. فرمول اسید سولفوریک ، H2SO4 ، نشان دهنده وجود یک اتم گوگرد است که توسط دو ترکیب هیدروکسید و دو اتم اکسیژن احاطه شده است. واکنش اسید سولفوریک 98 درصد با آب گرمازا است.
باید توجه داشته باشید که این اسید سولفوریک 98 درصد بسیار قوی است برای رقیق کردن آن باید اسید را به آب اضافه کنید و هرگز برعکس آن را انجام ندهید زیرا گرمایی که در هنگام ترکیب این دو ماده تولید می شود به طوری است که می تواند آب را به نقطه جوش رسانده و باعث پخش کردن اسید به اطراف شود.
کیمیا تهران اسید امکان فروش انواع خلوص اسید سولفوریک را به سفارش مشتریان گرامی دارد. جهت اطلاع از نحوه سفارش با شماره 36303710 داخلی بازرگانی تماس حاصل فرمایید. اسید با درصد خلوص متفاوت وجود دارد لطفا با ما در ارتباط باشید.
خرید سولفوریک از طریق سایت و ارتباط تلفنی به صورت حضوری وغیر حضوری امکان پذیر است.
بستـــه بندی
گالن 20 لیتری
گالن 2.5 لیتری
بشکه 220 لیتری
تانکر 1000 لیتری
| اسید سولفوریک 98 درصد | جوهر گوگرد دارای غلظت 98 درصد به طور معمول تولید می گردد که به اسید سولفوریک غلیظ معروف است. |
| اسید سولفوریک 50 درصد | اسید 50 درصد مورد استفاده به عنوان اسید کود |
| اسید سولفوریک 35 درصد | اسید سولفوریک 35 درصد اسید باطری مورد استفاده برای باتری های سرب اسیدی |
| اسید سولفوریک کمتر از 30 درصد | اسید سولفوریک رقیق شده کمتر از 30 درصد در صنایع مختلف |
| اسید سولفوریک وان یا دو بار تصفیه | پرکاربرد در وان آبکاری |
کاربرد اسید سولفوریک بسیار گسترده بوده و بخش های مختلفی از صنایع از این ماده بهره می گیرند. علت استفاده این ماده را باید خاصیت اسیدی قوی آن دانست که می تواند ضمن کاهش اسیدیته محیطی که در آن قرار می گیرد، به عنوان حلال و ماده ای خورنده هم استفاده های فراوانی داشته باشد. کاربرد اسید سولفوریک به صنعت محدود نمی شود و حتی در بخش صنایع غذایی هم شاهد استفاده از این ماده هستیم. در ادامه شما را با عمده کاربرد اسید سولفوریک در بخش های مختلف آشنا می کنیم.
اصلی ترین مورد استفاده اسید سولفوریک در کشاورزی است، به نحوی که حدود 60 درصد از کل تولیدات این ماده در دنیا به بخش کشاورزی و تهیه انواع کودها اختصاص یافته است. اسید سولفوریک در کشاورزی باعث کاهش اسیدیته خاک می شود و در مواقعی که میزان قلیایی بودن خاک افزایش پیدا کرده است، می تواند راهگشا باشد. هم چنین از این ماده به منظور تولید کودهای شیمیایی آمونیوم سولفات بهره گرفته می شود. از دیگر موارد استفاده اسید سولفوریک در کشاورزی، باید به افزایش میزان نفوذ پذیری خاک اشاره کرد. برخی از خاک ها نظیر خاک رس، امکان نفوذ آب به خاک را نمی دهند و حتی پس از گذشت چند روز از آبیاری شاهد عدم جذب آب خواهیم بود. اسید سولفوریک می تواند در این زمینه راهگشا بوده و با افزایش میزان نفوذ پذیری خاک، به تغذیه بهتر گیاهان منجر شود. با بهره گیری از کودهای حاوی این ماده می توان انتظار داشت که تهویه خاک به درستی صورت گیرد و کیفیت محصول نهایی افزایش پیدا کند.
یکی دیگر از موارد کاربرد اسید سولفوریک در تصفیه آب می باشد. این ماده می تواند میزان قلیایی بودن آب ها را کاهش داده و در مواردی که نیاز به تنظیم PH وجود دارد از این ماده بهره گرفته می شود. هم چنین می توان کاربرد اسید سولفوریک در تصفیه آب را در دستگاه های تصفیه آب و به منظور شست و شوی دستگاه ها نام برد. این ماده به عنوان نوعی اسید که قابلیت از بین بردن یون های سخت و هم چنین چربی ها را دارد، در پاکسازی فیلترهای دستگاه ها تصفیه آب موثر واقع می شود.
اسید سولفوریک به علت خاصیت اسیدی بالایی که دارد، به عنوان نوعی چربی زدا در شوینده ها مورد بهره برداری قرار می گیرد. کاربرد اسید سولفوریک در شوینده ها از آن حیث است که می تواند چربی و مواد آلوده را در خود حل ساخته و به همین دلیل در شوینده های خانگی شاهد استفاده از آن هستیم. این ماده قابلیت هیدرولیز بسیار بالایی دارد و به عنوان یک اسید قوی می تواند در از بین بردن لیپیدها، چربی و به ویژه موادی که به سطوح چسبیده و جدا نمی شوند، موثر باشد.
بخش عمده ای از کاربرد اسید سولفوریک در چرم سازی است. همان طور که اشاره شد، اسید سولفوریک می تواند به عنوان یک چربی زدا و ضد لیپید عمل کند. چرم طبیعی هم حاوی مقادیری مواد زائد از این قبیل می باشد. چربی و موهای اضافی از بخش هایی از چرم است که باید به شیوه ای آنها را زدود. کاربرد اسید سولفوریک در چرم سازی در این قسمت می باشد که سبب می شود مواد زائد و چربی ها از چرم جدا شده و پوست، آماده تبدیل به محصول نهایی گردد. خاصیت ضد چربی و قدرت هیدرولیز بالای این اسید باعث می شود که این قابلیت در صنعت چرم سازی را داشته باشد. هم چنین دیگر کاربرد اسید سولفوریک در چرم سازی را باید جداسازی آهک از چرم عنوان کرد که بخشی اصلی در فرآیند چرم سازی است.
باتری ماشین دارای نوعی اسید است که به واسطه ماده ای رقیق شده است. کاربرد اسید سولفوریک در باتری ماشین در این قسمت می باشد و می توان آن را به نام اسید باتری نیز شناسایی کرد. امروزه در باتری های خودروها، از اسید سولفوریک و آب استفاده می شود. با بهره گیری از آب، اسید سولفوریک را رقیق کرده و آن را آماده استفاده در باتری خودروها می کنند.
شاید جالب باشد که ماده ای با این حجم از خورندگی و اسیدی بودن، به عنوان نوعی ماده خوراکی در حال استفاده است. اسید سولفوریک خوراکی غالبا نوعی از این اسید است که به شدت رقیق شده است. این ماده را به عنوان نوعی افزودنی به مواد غذایی اضافه می کنند. در چنین شرایطی میکروارگانیسم ها، نمی توانند به درستی فعالیت کرده و با مهار عملکرد آنها، زمینه برای بالا رفتن عمر مفید مواد غذایی فراهم می شود. هم چنین در شرایطی که محیط مواد غذایی به اسیدی شدن نیاز داشته باشد، از اسید سولفوریک خوراکی بهره گرفته می شود.
همان طور که عنوان شد، بخش عمده کاربرد اسید سولفوریک در صنعت است. از آنجایی که توضیح همه موارد کاربرد این ماده در صنعت در حوصله این متن نمی گنجد، به اشاره موارد کاربرد آن به اختصار در این بخش پرداخته ایم.
استفاده از سولفوریک اسید در تولید گوگرد مرسوم می باشد.
اسید سولفوریک در تولید آمونیاک مورد استفاده صنعت شیمیایی کاربرد دارد.
کاربرد سولفوریک اسید در تولید اسید باطری که باید توسط متخصص شیمی انجام پذیرد.
سولفوریک برای تولید سولفات کلسیم، هیدروژن فلوراید و اسید فسفریک استفاده می شود.
تولید مواد منفجره، سلفون، استات و منسوجات ویسکوز، روان کننده ها، غیر فلزات آهنی و باتری
استفاده از این اسید در فرایندهای شیمیایی مانند اسیدی کردن چربی روغن، کاهش آلومینیوم، تصفیه آب
از کاربردهای مهم اسید سولفوریک برای تولید سولفات آلومینیوم است که به آلوم سازنده کاغذ معروف است.
سولفات آمونیوم به عنوان کود مهم ازت، به عنوان محصولی جانبی در کارخانه های تولید آهن و فولاد، تولید می شود که برای تهیه آن از اسید سولفوریک بهره گرفته می شود. حدود 60 درصد تولید اسید سولفوریک برای تولید کودها به ویژه سوپر فسفات ها، آمونیوم فسفات و سولفات های آمونیوم استفاده می شود.
عمده ترین کاربرد اسید سولفوریک برای تولید اسید فسفریک است که برای تولید کودهای فسفات مورد استفاده قرار می گیرد.
حدود 6 درصد از تولید اسید سولفوریک مربوط به رنگدانه هاست و شامل رنگ، مینا، چاپ جوهر، پارچه های روکش دار و کاغذ است.
برای تولید هیدروکسید آلومینیوم که در تصفیه خانه هابرای تصفیه ناخالصی ها و هچنین برای بهبود طعم آب، اسید سولفوریک مورد استفاده قرار می گیرد.
اسید سولفوریک حدود 20 درصد در صنعت شیمیایی جهت تولید مواد شوینده، رزین های مصنوعی، رنگ کننده ها، داروسازی، کاتالیزورهای نفتی، حشره کش ها و ضد یخ مورد بهره برداری قرار می گرد.
اسید سولفوریک در صنعت آهن و فولاد مورد استفاده قرار می گیرد تا اکسیداسیون، زنگ زدگی و پوسته پوسته شدن از ورق و شمش قبل از فروش به صنعت خودرو و لوازم خانگی بزرگ برطرف شود.
پرسش اینجاست که این اسید پر مصرف چگونه تولید می شود که بتواند پاسخ گوی نیاز بخش های مختلف صنایع باشد؟ در پاسخ باید گفت که تولید اسید سولفوریک توسط گازهایی که به صورت طبیعی از آتش فشان ها خارج می شود، به دست می آید. اما این میزان برای حجم بالای نیاز به این ماده پاسخ گو نمی باشد. بنابراین شیوه تولید صنعتی و آزمایشگاهی این ماده مطرح می شود.
به منظور تولید اسید سولفوریک آزمایشگاهی می توان گاز SO3 را در آب حل نمود و به این شیوه به اسید سولفوریک دست یافت. این واکنش فرآیندی خطرآفرین و حساس است و توصیه می شود تنها در مراکز و آزمایشگاه هایی که کلیه تجهیزات ایمنی لازم را دارا هستند، صورت گیرد. تولید اسید سولفوریک به شیوه صنعتی و آزمایشگاهی سبب شده تا نیازهای بخش های مختلف صنایع به این ماده تا حد قابل قبولی مرتفع گردد.
از این اسید در تهیه و تولید کود و انواع مواد شیمیایی، پالایش نفت، تولید آهن و فولاد و مصارف دیگر مورد استفاده قرار می گیرد. همچنین از سولفوریک اسید در غلظت های مختلف برای ساخت کود، رنگدانه ها، رنگ ها، مواد منفجره، مواد شوینده و پاک کننده اسیدی، نمک و اسیدهای معدنی استفاده می شود. یکی از مهم ترین کاربردهای سولفوریک در صنایع تولید باتری های سرب اسیدی می باشد چرا که این اسید به عنوان الکترولیت در باتری ها مورد استفاده قرار می گیرد.
سامانه فروش آنلاین کیمیا تهران اسید، با بهره گیری از مجرب ترین افراد در زمینه فروش، حمل و نقل و انبار داری اقدام به فروش اسید سولفوریک گرفته است. شما مصرف کنندگان گرامی که به کیفیت محصولی خریداری شده خود اهمیت می دهید، می توانید با خیال راحت، خرید اسید سولفوریک خود را به سامانه کیمیا تهران اسید بسپارید. خرید اسید سولفوریک از این مرکز به علت استفاده از کارشناسان بازرگانی خبره، می تواند تجربه ای خوشایند از خرید اینترنتی مواد شیمیایی باشد. این امکان برای شما مصرف کننده گرامی فراهم شده است که با خرید اسید سولفوریک با کیفیت، محصول را در محل خود دریافت نمایید. هم چنین در زمان تهیه مخصول می توانید از کارشناسان بازرگانی ما مشاوره های رایگان محصولی دریافت نمایید. در چنین شرایطی می توان انتظار داشت که تهیه اسید سولفوریک برای شما با بهترین شرایط به انجام برسد. از آنجایی که این ماده اسیدی قدرتمند و خورنده است، بسیار ضروری است که خرید اسید سولفوریک از مراجع معتبر تهیه شود تا خطرات انبارداری و حمل و نقل متوجه شما مصرف کننده عزیز نگردد. تنها یک تماس تلفنی با کارشناسان مجموعه تهران اسید کافی است تا بتوانید به محصول مورد نظر خود دست یافته و در کمترین زمان ممکن آن را در محل خود تحویل بگیرید.
به عنوان مصرف کننده یک محصول، همواره توجه به فاکتور قیمت از اولویت های اصلی و مهم خواهد بود. قیمت اسید سولفوریک در سامانه فروش آنلاین کیمیا تهران اسید، به نسبت دیگر مراکزی که این ماده را به فروش می رسانند، پایین تر است. اما علت چیست؟
اشتباه نکنید! علت قیمت پایین این محصول، بی کیفیت بودن آن نمی باشد. کیمیا تهران اسید یکی از مراجعی است که اقدام به فروش مستقیم محصولات خود نموده است. این به معنای آن است که واسطه هایی که در جریان فروش اسید سولفوریک و دیگر مواد شیمیایی وجود داشتند، حذف شده اند. به دنبال حذف واسطه ها، می توان انتظار داشت که قیمت اسید سولفوریک کاهش چشم گیری داشته باشد. این در حالی است که کیفیت این محصول در این فرآیند دست خوش تغییر نمی شود. شما می توانید برای کسب اطلاع از قیمت اسید سولفوریک، با کارشناسان بخش بازرگانی ما تماس حاصل کرده و نسبت به خرید اسید سولفوریک ارزان قیمت اقدام نمایید. کیمیا تهران اسید هدف اصلی خود را جلب رضایت شما مصرف کنندگان گرامی قرار داده است و در این راستا، همه تلاش خود را به کار بسته است. تنها با یک بار خرید از این سامانه فروش آنلاین محصولات شیمیایی، این اطمینان را به شما می دهیم که به مشتری همیشگی این مجموعه بدل خواهید شد.
هنگام استفاده و کار با اسید سولفوریک باید همیشه از تجهیزات حفاظتی استفاده شود.
در صورت مصرف خوراکی بلافاصله باعث آسیب جبران ناپذیر روی اندام های داخلی بدن می شود و ممکن است باعث مرگ شود.
اسید سولفوریک باعث ایجاد سوختگی شدید می شود، به ویژه در غلظت های بالا و همچنین در مقایسه با سایر اسیدها خاصیت خورندگی بالاتری دارد. این ماده خاصیت دهیدراته کنندگی قوی روی کربوهیدرات ها دارد، گرمای زیادی آزاد می کند و باعث سوختگی ثانویه می شود. براین اساس تاثیر آن روی چشم بسیار زیاد است و بلافاصله منجر به کوری دائمی می شود.
از تابش نور مستقیم دور نگه داشته شود.
ماسه، آهک و سودا اش برای شرایط اضطراری باید در انبار موجود باشد.
از نگهداری در مجاورت مواد آلی، فلزات، نیترات ها، کلرات ها خود داری شود.
سولفوریک باید در محل تمیز همراه با کف ضد اسید، زهکشی مناسب و تهویه انبار شود.
حمل و نقل باید در مخازن فولادی انجام گیرد.
داخل تانکرها باید مجهز به صفحات موج گیر باشد.
با برچسب ماده خورنده و با احتیاط حمل و نقل شود.
تانکرهای حمل اسید باید مجهز به محل بارگیری حفاظت شده مجهز به سرریز و درپوش مخصوص و مطمئن بوده و شیر فلکه تخلیه آنها نیز مجهز به محل بارگیری محافظت شده مجهز به سر ریز و در پوش مخصوص و مطمئن بوده و شیر فلکه تخلیه آنها نیز مجهز به پولک کوری باشد.
| H2SO4 | Formol |
| 3651 | Lab.NO |
| شماره 1 | Sampl.NO |
| 13 | Fe (ppm)j |
| 1.81 | Sp.G.(g/ml)k |
| 98.6 | % |
هنگام استفاده و کار با اسید سولفوریک باید همیشه از تجهیزات حفاظتی استفاده شود.
در صورت مصرف خوراکی بلافاصله باعث آسیب جبران ناپذیر روی اندام های داخلی بدن می شود و ممکن است باعث مرگ شود.
اسید سولفوریک باعث ایجاد سوختگی شدید می شود، به ویژه در غلظت های بالا و همچنین در مقایسه با سایر اسیدها خاصیت خورندگی بالاتری دارد. این ماده خاصیت دهیدراته کنندگی قوی روی کربوهیدرات ها دارد، گرمای زیادی آزاد می کند و باعث سوختگی ثانویه می شود. براین اساس تاثیر آن روی چشم بسیار زیاد است و بلافاصله منجر به کوری دائمی می شود.
از تابش نور مستقیم دور نگه داشته شود.
ماسه، آهک و سودا اش برای شرایط اضطراری باید در انبار موجود باشد.
از نگهداری در مجاورت مواد آلی، فلزات، نیترات ها، کلرات ها خود داری شود.
سولفوریک باید در محل تمیز همراه با کف ضد اسید، زهکشی مناسب و تهویه انبار شود.
حمل و نقل باید در مخازن فولادی انجام گیرد.
داخل تانکرها باید مجهز به صفحات موج گیر باشد.
با برچسب ماده خورنده و با احتیاط حمل و نقل شود.
تانکرهای حمل اسید باید مجهز به محل بارگیری حفاظت شده مجهز به سرریز و درپوش مخصوص و مطمئن بوده و شیر فلکه تخلیه آنها نیز مجهز به محل بارگیری محافظت شده مجهز به سر ریز و در پوش مخصوص و مطمئن بوده و شیر فلکه تخلیه آنها نیز مجهز به پولک کوری باشد.
از آنجایی که واکنش هیدراتاسیون اسید سولفوریک بسیار گرمازاست لذا رقیق سازی همیشه باید با افزودن اسید به آب انجام شود. همچنین این کار باید توسط متخصص شیمی صورت گیرد زیرا کاری بسیار خطرناک است و ممکن است عوارض غیر قابل جبران داشته باشد.
بله؛ برای خاموش کردن آتش آن باید از مواد شیمیایی خشک استفاده شود. جهت اطفاء حریق هرگز از آب استفاده نکنید چرا که باعث تغلیظ اسید می شود که مخلوط آن بسیار واکنش پذیر است و بخار اسید سولفوریک و حرارت شدید تولید می کند.
شرکت کیمیا تهران اسید عرضه کننده مستقیم این اسید در بازار تهران و شهرستان ها است که می توانید مقدار درخواستی خود را در هر بسته بندی به صورت خرد و فله استعلام بگیرید.
در این ویدیو می توانید نگاهی به بارگیری و فروش اسید سولفوریک و دیگر محصولات با کیفیت تهران اسید داشته باشید.
اسید سولفوریک
35 درصد, 50 درصد, 98 درصد
صنعتی / آزمایشگاهی
H2SO4
98/078
1/84
10 درجه سانتیگراد
338 درجه سانتیگراد
✔️بشکه 220 لیتری فلزی, ✔️تانکر 1000 لیتری, ✔️گالن 2.5 لیتری, ✔️گالن 20 لیتری, ✔️گالن 5 لیتری, گالن 5 لیتری صنعتی, بسته 1 کیلوگرمی/1لیتری
جوهر گوگرد / Sulfuric Acid / هیدروژن سولفات